






《无机化学1化学平衡PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为607.5 KB,总共有33页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 33页
- 607.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
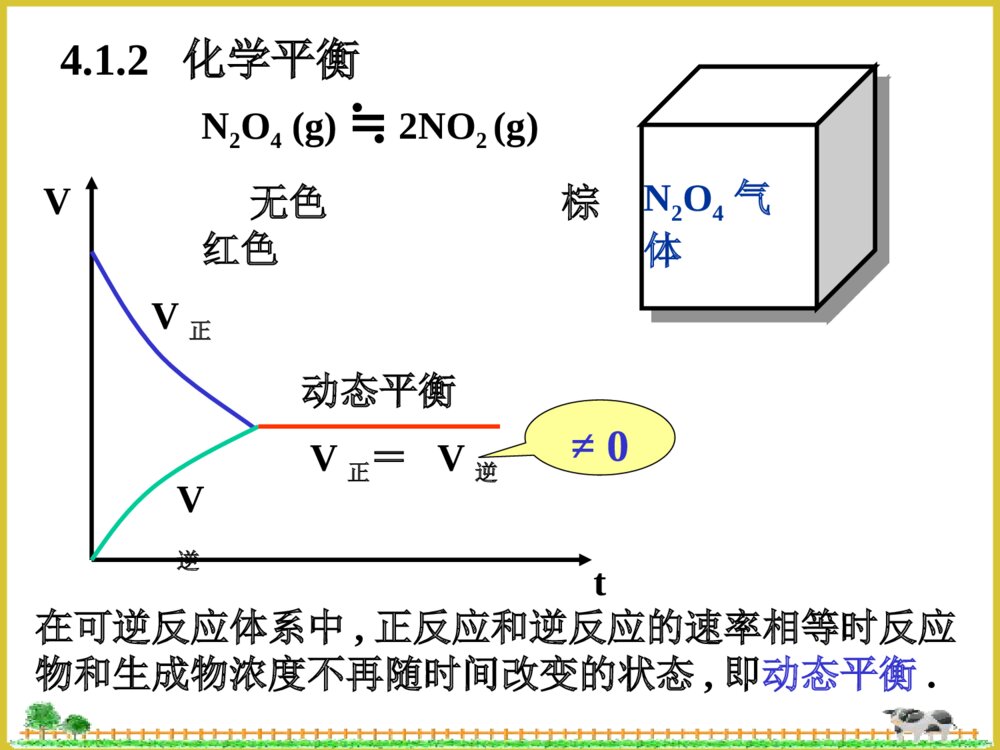
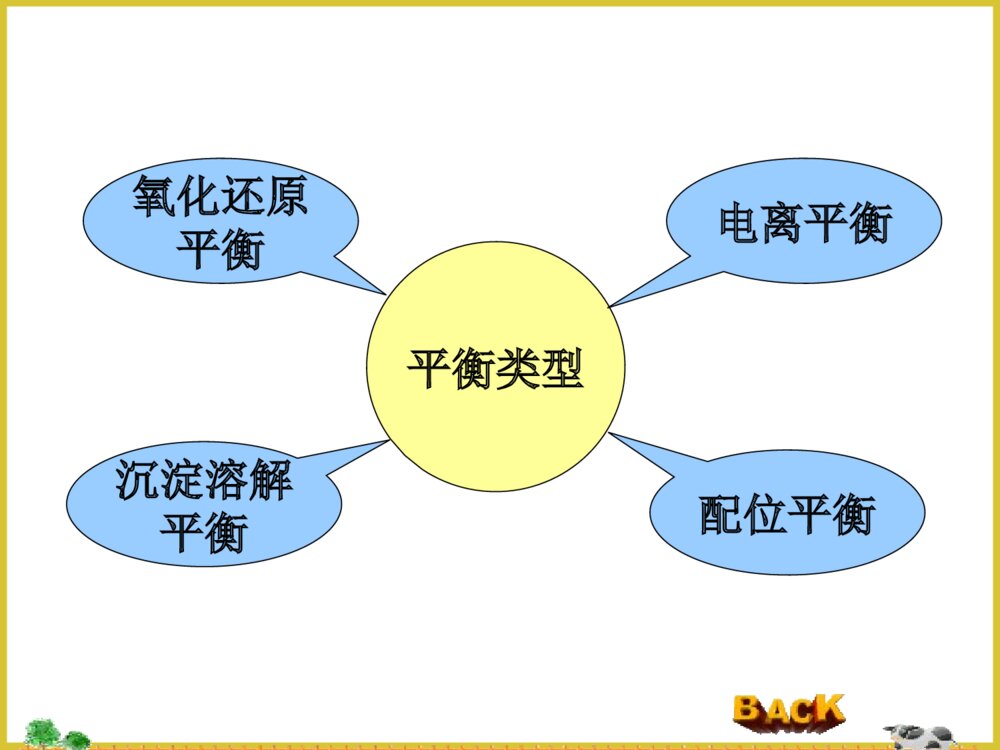
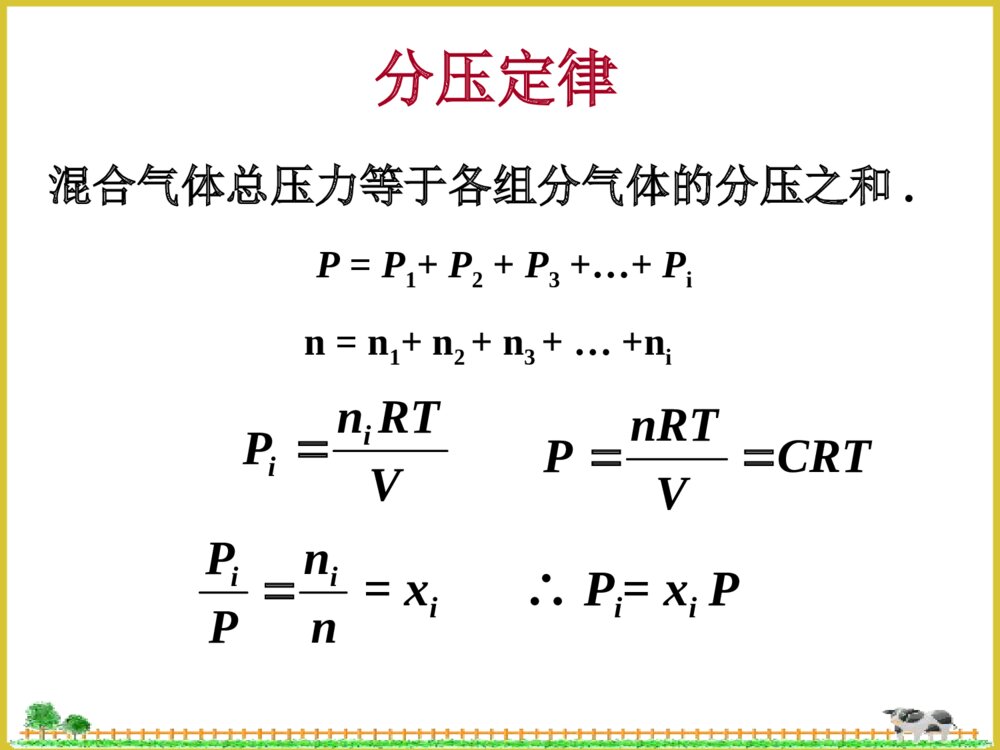
化学平衡§4.1化学反应的可逆性和化学平衡§4.2平衡常数§4.3化学平衡的移动§4.1化学反应的可逆性和化学平衡4.1.1化学反应的可逆性4.1.2化学平衡4.1.1化学反应的可逆性1、不可逆反应:只能向一个方向进行的反应。2、可逆反应(1)概念:在同一条件下,既能向一个方向又能向相反方向进行的化学反应。a.可逆程度不同,有的彻底向右进行,有的则不然.b.对于同一反应,在不同的条件下,可逆性也会不同.例:2H2(g)+O2(g)2H≒2O(g)873K-1273K时,生成水的方向占优势4273-5273K时,分解过程占优势4.1.2化学平衡N2O4气体N2O4(g)≒2NO2(g)无色棕红色tVV正V逆动态平衡V正=V逆在可逆反应体系中,正反应和逆反应的速率相等时反应物和生成物浓度不再随时间改变的状态,即动态平衡.≠0平衡类型氧化还原平衡配位平衡沉淀溶解平衡电离平衡§4.2平衡常数4.2.1经验平衡常数4.2.2标准平衡常数和吉布斯自由能改变4.2.3多重平衡混合气体总压力等于各组分气体的分压之和.VRTnPiiP=P1+P2+P3+…+Pin=n1+n2+n3+…+niCRTVnRTPnnPPii=xi∴Pi=xiP分压定律4.2.1经验平衡常数bahgBAHGKc][][][][(液相反应)bBaAhHgGPPPPKp)()()()((气相反应)若a+b=g+h,则Kc和Kp都没有单位;若a+b≠g+h,则Kc和Kp都有单位(一般都省略).37.0][][4222ONNO在373K时:对于任一个可逆反应aA+bBgG+hH≒(1)定义:在一定温度下,当可逆反应达到平衡状态时,生成物浓度幂的乘积与反应物浓度幂的乘积之比为常数。浓度平衡常数:压力平衡常数:(2)Kc和Kp的关系RTAVRTnPAA][RTGVRTnPGG][RTHVRTnPHH][RTBVRTnPBB][)()(][][][][)()()()(bahgbahgbBaAhHgGRTBAHGPPPPKp∴Kp=Kc(RT)n△,n=g+h-(a+b)△。△n是反应式中生成物和反应物计量系系数之差。当△n=0时,Kp=Kc当△n≠0时,Kp≠Kc(3)平衡常数表达式地书写规则①纯固体,液体和稀溶液中水的浓度不写入K的表达式;②K值与反应方程式的写法有关:N2O4(g)≒2NO2(g)36.0][][42221ONNOK例:在373K时,1/2N2O4(g)≒NO2(g)60.0][][2/14222ONNOK1/3N2O4(g)≒2/3NO2(g)72.0][][3/1423/223ONNOKK1=(K2)2=(K3)3③K正×K逆=1(4)平衡转化率转化率就是反应物转化为产物的百分数,即:%100反应物的起始浓度浓度平衡时已反应的反应物H2(g)+CO2(g)CO(g)+H≒2O(g)起始浓度:0.020.0200mol/L平衡浓度:0.0050.0050.0150.015mol/L转化浓度:0.0150.015mol/L%75%10002.0015.0转化率【例1】反应CO+H2O≒H2+CO2,在某温度T时,Kc=9,若CO和H2O的起始浓度均为0.02mol.L-1,求CO平衡转化率。解:设消耗了CO的浓度为xmol.L-1CO+H2O≒H2+CO2起始浓度0.020.0200mol.L-1平衡浓度0.02-x0.02-xxxmol.L-19)02.0)(02.0(]][[]][[222xxxxOHCOCOHKcx=0.015mol.L-1,[H2]=[CO2]=0.015mol.L-1转化率为:(0.015/0.02)×100%=75%同理,可求得当Kc=4和Kc=1时,CO转化率分别为67%和50%。所以,K越大,转化率越大。4.2.2标准平衡常数和吉布斯自由能改变利用热力学有关公式间接求算得到的平衡常数。bahgCBCACHCGKc)/]([)/]([)/]([)/]([(1)标准平衡常数Kcø(无量纲的)对于可逆反应aA+bBgG+hH≒(液相反应)CHCGCBCA/][/][,/][,/][和称为相对浓度,其中Cø=1mol.L-1Kcø=Kc(Cø)a+b-g-h=Kc(2)标准平衡常数Kpø(无量纲的)bBaAhHgGpPpPpPpPKp)/]([)/]([)/]([)/]([对于气相反应aA+bB≒gG+hHPPPPPPPPHGBA/][/][,/][,/][和称为相对压力,其中Pø=101325PaKpø=Kp(Pø)a+b-g-h99.0)1001.1/1000.1()1001.1/1000.1()/]([)/]([552552PaPaPaPapPpPKpAB[例2]某温度下反应A(g)2B(g)≒达到平衡时,PA=PB=1.00×105Pa,求Kpø。解:若以分压直接代入公式,则得经验平衡常数:计算Kpø时,一定要代入相对分压值,不能将气体得分压值Pi直接代入,否则会产生错误。PaPaPaPPKpAB552521000.1)1000.1()1000.1((3)化学平衡与⊿rG的关系温故而知新自发反应过程的判断的依据:⊿rGT,P<0反应自发进行⊿rGT,P=0反应是可逆的,处于平衡状态⊿rGT,P>0反应不能自发进行对于液相反应aA+bB≒gG+hHbBaAhHgGCCCCCCCCRTrGrG)/()/()/()/(ln\'\'\'\'当体系处于平衡状态时,△rG=0,则:bBaAhHgGCCCCCCCCRTrG)/()/()/()/(ln\'\'\'\'此时,CA’、CB’、CG’和CH’分别等于平衡浓度。CKRTrGln化学等温式bBaAhHgGCCCCCCCCCRTKRTrG)/()/()/()/(lnln\'\'\'\'CbBaAhHgGQCCCCCCCC)/()/()/()/(\'\'\'\'令CCKQRTrGln浓度商bBaAhHgGPPPPPPPPPRTKRTrG)/()/()/()/(lnln\'\'\'\'同理,对于气相反应:PPKQRTrGlnQ=Kø,⊿rGT,P=0,反应处于平衡状态QKø,⊿rGT,P>0,逆向自发进行,至Q=K为止QP为分压商4.2.3利用多重平衡规则计算平衡常数<1>SO2+1/2O2SO≒32/12231]][[][OSOSOK<2>NO2NO+1/2O≒2][]][[22/122NOONOK<3>SO2+NO2SO≒3+NO]][[]][[2233NOSONOSOK从反应式看:<3>=<1>+<2>从经验平衡常数表达式推导:K3=K1×K2⊿rG1ø⊿rG2ø⊿rG3ø⊿rG3ø=⊿rG1ø+⊿rG2øCKRTrGlnK3ø=K1ø×K2ø【例3】已知下列反应的平衡常数:(1)HCN⇋H++CN-K1ø=4.9×10-10(2)NH3+H2O⇋NH4++OH-K2ø=1.8×10-5(3)H2O⇋H++OH-Kwø=1.0×10-14试计算下面反应的平衡常数:(4)NH3+HCN⇋NH4++CN-解:(4)=(1)+(2)-(3)根据多重平衡规则:88.0100.1108.1109.41451021WKKKK§4.3化学平衡的移动3.3.1浓度对化学平衡的影响3.3.2压力对化学平衡的影响3.3.3温度对化学平衡的影响3.3.4选择合理生产条件的一般原则4.3.1浓度对化学平衡的影响(液相反应)1、增大反应物浓度或减少产物浓度,使浓度商Q减小,Q0,升高温度,平衡向正向(吸热)移动;降低温度,平衡向逆向(放热)移动。)11(ln2112TTRHKKmr△rGmø=△rHmø–T.△rSmøKRTGmrln-RTlnKø=△rHmø–T.△rSmøRSRTHKmrmrln(2)当△rHmø<0,升高温度,平衡向逆向(吸热)移动;降低温度,平衡向正向(放热)移动。LeChatelier(勒厦特列)原理即平衡移动原理:如果改变平衡状态的任一条件,如浓度、压力和温度等,平衡就向能消除外来影响,恢复原有状态的方向移动。4.3.4催化剂的影响:不能改变平衡状态,它只不过缩短了达到平衡的时间。4.3.4选择合理生产条件的一般原则①增大反应物的浓度(或分压),不仅可提高反应速率,还可促使平衡正向进行。②对于气体分子数目减少的气相反应,增加压力不仅可使平衡向正反应方向移动,还能提高反应物的产率。③升高温度能够提高化学反应速率,对于吸热反应可使平衡向正反应方向移动。本章小结1.实验平衡常数Kp(或Kc)和标准平衡常数Kpø(或Kcø)的区别;2.平衡常数表达式的书写规则和多重平衡;3.反应物的转化率概念;4.化学反应等温式,利用反应商Q与Kø的相互大小判断自发进行的方向;5.化学平衡移动的影响因素及LeChatelier原理练习1.达到平衡时,各反应物和生成物的浓度一定相等。2.标准平衡常数数值大,说明正反应一定进行;标准平衡常数数值小,说明正反应不能进行。3.对于放热反应来说,升高温度会使其标准平衡常数变小,反应的转化率降低。4.某物质在298K时分解率为15%,在373K时分解率为30%,由此可知该物质的分解反应为放热反应。1.当反应2NO2(g)N≒2O4(g)达到平衡时,降低温度混合物的颜色会变浅,说明此反应的逆反应是A.△rHmø=0的反应B.△rHmø>0的反应C.△rHmø<0的反应D.气体体积减小的反应2.在1073K,反应CaO(s)+CO2(g)≒CaCO3(s)Kø=3.1×10-5,则CO2的相对平衡分压为A.3.1×10-5B.(3.1×10-5)1/2C.1/(3.1×10-5)D.(3.1×10-5)23.已知反应H2(g)+Br2(g)≒2HBr(g)的标准平衡常数K1ø=4×10-2,则同温度下反应HBr(g)≒½H2(g)+1/2Br2(g)的K2ø=A.(4×10-2)-1B.2×10-1C.4×10-2D.(4×10-2)-1/2例:P67-9解:PCl5(g)⇋PCl3(g)+Cl2(g)平衡浓度:1.000.2040.204(mol·L-1)反应浓度:0.2040.2040.204(mol·L-1)起始浓度:1.20400(mol·L-1)225231016.400.1204.0][]][[PClClPClKcPCl5(g)⇋PCl3(g)+Cl2(g)起始浓度:1.204/200(mol·L-1)平衡浓度:0.602-xxx(mol·L-1)225231016.4602.0][]][[xxPClClPClKc解得x=0.139mol·L-1而[PCl5]=0.602-0.139=0.463mol·L-1[PCl3]=[Cl2]=0.139mol·L-1



















